Русский | English
Физиология желчи |
|
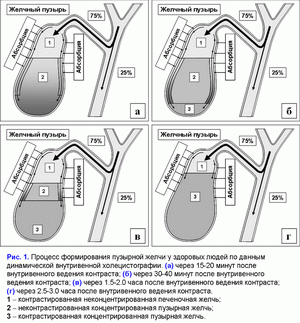
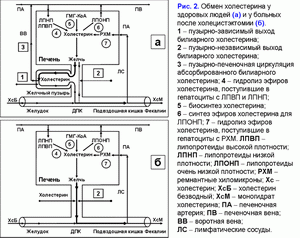
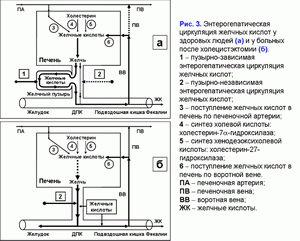
Поделиться ссылкой: Прочитать статью в pdf формате Функции желчного пузыряПреобладающая точка зрения - желчный пузырь не является жизненно необходимым органом (1). Желчный пузырь обладает абсорбционной, концентрационной, секреторной и эвакуаторной функциями (2, 3). Первые две взаимосвязаны. Абсорбционная функция желчного пузыря включает абсорбцию воды, Na+, холестерина, фосфолипидов, гидрофильных протеинов и т.д. (4-14). Учитывая, что абсорбция желчных кислот слизистой желчного пузыря составляет всего 2-6% от общей концентрации в пузырной желчи, концентрационная функция желчного пузыря заключается в аккумуляции желчных кислот печеночной желчи в желчном пузыре (10-12, 15, 16). Секреторная функция желчного пузыря включает секрецию гликопротеинового муцина слизистой желчного пузыря, ионы Н+, Cl- и, возможно, иммуноглобулины и Ca2+ (5, 17-23). Концептуальная модель процесса формирования пузырной желчиУчитывая отсутствие детализации процесса поступления печеночной желчи в желчный пузырь, нами введены два новых термина: “активный” и “пассивный” пассаж печеночной желчи. “Активный” пассаж зависит от объема опорожнения желчного пузыря после еды или в межпищеварительном периоде, “пассивный” пассаж связан со скоростью абсорбции воды в желчном пузыре. Следовательно, скорость поступления печеночной желчи в желчный пузырь включает “активный” и “пассивный” пассаж. Во время “активного” пассажа поступает только 1 объем (из 6-9) печеночной желчи, во время “пассивного” пассажа – 5-8 объемов. По данным нашей математической модели скорость поступления печеночной желчи в желчный пузырь составляет 281±58 мкл/мин, что соответствует 80% от базальной секреции печеночной желчи (350 мкл/мин) (24). Это косвенно подтверждается тем, что в желчном пузыре аккумулируется 78±10% желчных кислот от их общего пула (25). Концентрация общих желчных кислот в пузырной желчи зависит от скорости поступления желчных кислот печеночной желчи в желчный пузырь (r=+0.87, р<0.001) (24). Детализация процесса поступления печеночной желчи в желчный пузырь позволяет сделать предположение, что 83-89% желчных кислот, содержащиеся в пузырной желчи, поступают с “пассивным” пассажем и только 11-17% желчных кислот - с “активным” пассажем печеночной желчи. Соответственно, “пассивный” пассаж печеночной желчи в желчный пузырь играет важную роль в механизме формирования пузырной желчи (рис. 1.а). В норме процесс заполнения желчного пузыря при внутривенном введении рентгенконтрастного вещества характеризуется определенными закономерностями (26). В течение первых 15-20 мин желчь состоит из двух слоев: верхнего контрастного и нижнего неконтрастного (рис. 1.а). Четкая граница между ними располагается горизонтально. На 30-40-й минуте пристеночно расположенная контрастированная желчь верхнего слоя сгущается, плотность ее возрастает благодаря наличию тяжелых атомов йода и начинает превышать плотность неконтрастированной концентрированной желчи. При этом “тяжелые” слои контрастированной желчи начинают стекать по стенкам, как бы обтекая неконтрастированную концентрированную желчь и скапливаться на дне (рис. 1.б). Тень желчного пузыря становится трехслойной: вверху располагается контрастированная, но неконцентрированная желчь, далее идет слой концентрированной, но неконтрастированной желчи, наконец, дистальный отдел пузыря заполнен контрастированной и концентрированной желчью. Граница между ними четкая и сохраняется при перемене положения тела обследуемого. Постепенно количество концентрированной контрастированной желчи на дне пузыря увеличивается, и верхняя граница нижнего слоя повышается (рис. 1.в). Однородность тени желчного пузыря наступает спустя 2.5-3.0 ч с момента введения препарата (рис. 1.г) (26). Следовательно, на голодный желудок, абсорбция воды слизистой шейки желчного пузыря играет ведущую роль в формировании пузырной желчи. По данным нашей математической модели скорость абсорбции воды слизистой желчного пузыря составляет 249±58 мкл/мин (или 5.55±1.24 мкл/см2/мин), что соответствует данным полученным in vivo (261±130 мкл/мин) (4, 24). Общее количество воды абсорбированной слизистой желчного пузыря за 12 часов составляет 179±41 мл (24). Выведение билиарного холестерина в просвет двенадцатиперстной кишкиДля понимания процессов выведения билиарного холестерина в просвет двенадцатиперстной кишки нами введены два новых термина: пузырно-зависимый и пузырно-независимый выход билиарного холестерина. Пузырно-зависимый выход билиарного холестерина зависит от эвакуаторного объема желчного пузыря и концентрации билиарного холестерина в пузырной желчи. Соответственно, пузырно-независимый выход билиарного холестерина зависит от объема и концентрации билиарного холестерина в печеночной желчи, поступающего напрямую в двенадцатиперстную кишку (рис. 2.а). После холецистэктомии наблюдается только пузырно-независимый выход билиарного холестерина в двенадцатиперстную кишку (рис. 2.б). Взаимосвязь между абсорбцией билиарного холестерина в желчном пузыре и подвздошной кишкеВ желчном пузыре везикулярный холестерин эффективно абсорбируется, мицеллярный - нет (7-12, 24, 27, 28). Абсорбция мицелл в подвздошной кишке в 100 раз эффективнее, чем везикул (29). Следовательно, чем больше абсорбция везикулярного холестерина в желчном пузыре, тем выше концентрация мицеллярного холестерина в пузырной желчи (индекс насыщения холестерином менее 1.0) и абсорбция холестерина в подвздошной кишке. И наоборот, снижение абсорбции везикулярного холестерина в желчном пузыре повышает его концентрацию в пузырной желчи (индекс насыщения более 1.0) и уменьшает абсорбцию холестерина в подвздошной кишке. Соотношение желчные кислоты/холестерин в пузырной желчи может определять способность кишечных смешанных мицелл к солюбилизации диетарного холестерина. Повышение этого соотношения более 10-12:1 (ИНХ < 1.0) – увеличивает солюбилизацию, уменьшение менее 7-10:1 (ИНХ > 1.0) – снижает. Влияние функций желчного пузыря на энтерогепатическую циркуляциюЧасть желчных кислот печеночной желчи поступает в желчный пузырь и аккумулируется в нем, другая часть – в двенадцатиперстную кишку и участвует в энтерогепатической циркуляции. Для понимания этих процессов нами введены два новых термина: пузырно-зависимая и пузырно-независимая энтерогепатическая циркуляция желчных кислот (рис. 3.а). Пузырно-зависимая энтерогепатическая циркуляция желчных кислот зависит от эвакуаторного объема желчного пузыря и определяет концентрацию желчных кислот пузырной желчи, участвующую в энтерогепатической циркуляции. Пузырно-независимая энтерогепатическая циркуляция включает часть желчных кислот печеночной желчи, не поступивших в желчный пузырь и попадающие напрямую в просвет двенадцатиперстной кишки. У здоровых людей 75-80% желчных кислот участвует в пузырно-зависимой энтерогепатической циркуляции и только 20-25% - в пузырно-независимой. Следовательно, концентрационная функция желчного пузыря заключается в аккумуляции желчных кислот печеночной желчи и исключении их из энтерогепатической циркуляции. После холецистэктомии доля желчных кислот, участвующих в пузырно-независимой энтерогепатической циркуляции, возрастает до 100% (рис. 3.б). Детализация этих процессов позволяет связать абсорбционную, концентрационную и эвакуаторную функции желчного пузыря с энтерогепатической циркуляцией желчных кислот. Скорость абсорбции воды слизистой желчного пузыря определяет “пассивный” пассаж печеночной желчи из печени в желчный пузырь и пузырно-независимую энтерогепатическую циркуляцию желчных кислот. Список литературы:
|
|
|