|
Поделиться ссылкой:
Прочитать статью в pdf формате
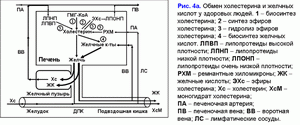
Механизм формирования пузырной желчи
Целесообразно выделить два момента в процессе формирования пузырной желчи: 1) на голодный желудок; 2) после сокращения желчного пузыря (1). Абсорбционная и концентрационная функции желчного пузыря определяют механизм формирования пузырной желчи.
In vitro скорость абсорбции билиарного холестерина слизистой желчного пузыря составляет 4.8±0.4 нмоль/см2/мин и зависит от концентрации холестерина в пузырной желчи (r= +0.60, p<0.001) (2-4). Принимая во внимание, что смешанные (желчная кислота лецитин-холестерин) мицеллы не абсорбируются слизистой желчного пузыря, то холестерин может абсорбироваться в виде мономеров или с фосфолипидными везикулами (1-9). Растворимость мономеров безводного холестерина в воде составляет 0.013 нмоль/мл, в интермицеллярной фазе – 0.260 нмоль/мл, а в фосфолипидных везикулах - 5.5 мкмоль/мл (10-15). Следовательно, соответственно растворимости безводного холестерина, он в большей степени (99.9%) будет абсорбироваться с фосфолипидными везикулами. Фосфолипидные везикулы могут абсорбироваться слизистой желчного пузыря тремя путями (1, 8, 9, 16-19). Следовательно, чем больше абсорбция везикулярного холестерина слизистой желчного пузыря, тем меньше концентрация холестерина в фосфолипидных везикулах в пузырной желчи.
Концентрационная функция желчного пузыря заключается в аккумуляции желчных кислот печеночной желчи в желчном пузыре, зависит от скорости поступления желчных кислот печеночной желчи и скорости абсорбции воды слизистой желчного пузыря, определяет концентрацию общих желчных кислот и формирование смешанных желчных мицелл в пузырной желчи (рис. 4а). В печеночной желчи 40-80% билиарного холестерина находится в фосфолипидных везикулах и 20-60% - в смешанных желчных мицеллах (15, 20, 21). Желчный пузырь, концентрируя желчные кислоты, формирует смешанные желчные мицеллы и повышает в них уровень билиарного холестерина до 80-100% (15, 20, 21). Следовательно, чем больше абсорбция воды слизистой желчного пузыря, тем больше пассаж желчных кислот печеночной желчи в желчный пузырь и выше концентрация общих желчных кислот в пузырной желчи.
Таким образом, высокая концентрация общих желчных кислот и низкая концентрация холестерина в фосфолипидных везикулах обуславливают низкий индекс насыщения в пузырной желчи (меньше 1.0), что определяет стабильность мицеллярных носителей билиарного холестерина и препятствует преципитации кристаллов моногидрата холестерина.
Судьба абсорбированного везикулярного билиарного холестерина
Часть абсорбированного холестерина может быть этерифицирована в эпителиальных клетках слизистой желчного пузыря с помощью АХАТ, где в норме ее активность составляет 92±23 пмоль/мин/мг белка и в 8-9 раз превышает таковую в микросомах печени (11±2 пмоль/мин/мг белка (22). Стимулированная экзогенным холестерином активность АХАТ в микросомах слизистой желчного пузыря повышается в 1.5 раза (162±37 пмоль/мин/мг белка) и в 3 раза превышает аналогичную активность АХАТ в микросомах печени (57±25 пмоль/мин/мг белка). Имеется положительная корреляция между концентрацией холестерина в пузырной желчи и АХАТ в микросомах слизистой желчного пузыря (r= +0.42, p<0.05). В микросомах слизистой желчного пузыря также синтезируется холестерин, и активность ГМГ-КоА-редуктазы в них составляет 28±6 пмоль/мин/мг белка. Но она в 4 раза ниже, чем в микросомах гепатоцитов (120±40 пмоль/мин/мг белка). Концентрация свободного холестерина в микросомах слизистой желчного пузыря (206±9 нмоль/мг белка) в 4 раза выше, чем в микросомах гепатоцитов (55±3 нмоль/мг белка), а этерифицированного (34±5 нмоль/мг белка) - в 3.5 раза (9±1 нмоль/мг белка) (22). Принимая во внимание низкую активность ГМГ-КоА-редуктазы и высокую активность АХАТ в микросомах слизистой желчного пузыря, положительную корреляцию между уровнем холестерина в пузырной желчи и в микросомах слизистой желчного пузыря (r= +0.75, p<0.01), повышенная концентрация свободного холестерина в микросомах эпителиальных клеток слизистой желчного пузыря может быть обусловлена только избыточной абсорбцией билиарного везикулярного холестерина. Это свидетельствует о том, что скорость поступления билиарного везикулярного холестерина в эпителиальные клетки слизистой желчного пузыря превышает в 4 раза таковую в гепатоциты.
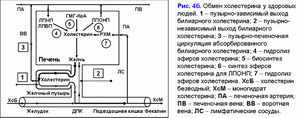
По аналогии с подвздошной кишкой, удаление абсорбированного везикулярного холестерина и фосфолипидов из стенки желчного пузыря может быть реализовано посредством ЛПВП и/или ЛПОНП (17, 18, 23-25). In vitro показано, что ЛПВП могут экстрагировать избыток холестерина из холестерин-насыщенных фосфолипидных везикул и растворять кристаллы холестерина (26, 27). Механизм удаления везикулярного холестерина и фосфолипидов с помощью ЛПВП считают преобладающим, и он определяется концентрацией ЛПВП в сыворотке крови и скоростью артериального кровотока в стенке желчного пузыря (28, 29). В стенке желчного пузыря ЛПВП, взаимодействуя с фосфолипидными везикулами, будут экстрагировать билиарный везикулярный холестерин и фосфолипиды и с током крови поступать в пузырную вену и через воротную вену - в печень (рис. 4б).
Это также подтверждается отрицательной корреляционной связью между индексом насыщения холестерина ИНХ в пузырной желчи и уровнем общего холестерина ОХс (r= -0.65, p<0.05) и Хс-ЛПВП (r= -0.62, p<0.05) в сыворотке крови у молодых практически здоровых женщин (30). В слизистой желчного пузыря ЛПОНП синтезируются в небольших количествах (31).
Абсорбированный везикулярный холестерин слизистой желчного пузыря, взаимодействуя с липопротеидами крови, может поступать по воротной вене в печень или в периферический кровоток (рис. 4б). Путь билиарного холестерина [кровь (липопротеиды) → печень (печеночная желчь - фосфолипидные везикулы) → желчный пузырь (абсорбция везикулярного холестерина) → воротная вена (липопротеиды) → печень или кровь] мы обозначили как пузырно-печеночная циркуляция холестерина (рис. 4б). Детализация этих процессов позволяет связать выделительную функцию печени, абсорбционную и эвакуаторную функции желчного пузыря с уровнем холестерина в сыворотке крови.
Список литературы:
- Turumin J.L., Shanturov V.A. The disturbance of the gallbladder bile formation in-patients with cholesterol gallstone disease. XIV International Bile Acid Meeting "Bile Acids in Hepatobiliary Diseases - Basic Research and Clinical Application" (Falk Symposium No. 93). Freiburg, Germany, 1996: Abstr. 105.
- Jacyna M.R., Ross P.E., Bakar M.A., Hopwood D., Bouchier I.A. Characteristics of cholesterol absorption by human gall bladder: relevance to cholesterolosis. J Clin Pathol 1987; 40(5): 524-529.
- Jacyna M.R. Interactions between gallbladder bile and mucosa: relevance to gallstone formation. Gut 1990; 31: 586-570.
- Ross P.E., Butt A.N., Gallacher C. Cholesterol absorption by the gallbladder. J Clin Pathol 1990; 43(7): 572-575.
- Ginanni Corradini S., Ripani C., Della Guardia P., Giovannelli L., Elisei W., Cantafora A., Pisanelli M.C., Tebala G.D., Nuzzo G., Corsi A., Attili A.F., Capocaccia L., Ziparo V. The human gallbladder increases cholesterol solubility in bile by differential lipid absorption: a study using a new in vitro model of isolated intra-arterially perfused gallbladder. Hepatology 1998; 28(2): 314-322.
- Ginanni Corradini S., Yamashita G., Nuutinen H., Chernosky A., Williams C., Hays L., Shiffman M.L., Walsh R.M., Svanvik J., Della Guardia P., Capocaccia L., Holzbach R.T. Human gallbladder mucosal function: effects on intraluminal fluid and lipid composition in health and disease. Dig Dis Sci 1998; 43(2): 335-343.
- Corradini S.G., Elisei W., Giovannelli L., Ripani C., Della Guardia P., Corsi A., Cantafora A., Capocaccia L., Ziparo V., Stipa V., Chirletti P., Caronna R., Lomanto D., Attili A.F. Impaired human gallbladder lipid absorption in cholesterol gallstone disease and its effect on cholesterol solubility in bile. Gastroenterology 2000; 118(5): 912-920.
- Koga A. Fine structure of the human gallbladder with cholesterolosis with special reference to the mechanism of lipid accumulation. Brit J Exp Pathol 1985; 66: 605-611.
- Secknus R., Darby G.H., Chernosky A., Juvonen T., Moore E.W., Holzbach A.R.T. Apolipoprotein A-I in bile inhibits cholesterol crystallization and modifies transcellular lipid transfer through cultured human gallbladder epithelial cells. J Gastroenterol Hepatol 1999: 14(5): 446-456.
- Loomis C.R., Shipley G.G., Small D.M. The phase behavior of hydrated cholesterol. J Lipid Res 1979; 20: 525-535.
- Chijiiwa K., Kiyosawa R., Nakayama F. Cholesterol monomer activity correlates with nucleation time in model bile. Clin Chim Acta 1988; 178: 181-192.
- Chijiiwa K., Nagai M. Interaction of bile salt monomer and cholesterol in the aqueous phase. Biochim Biophys Acta 1989; 1001: 111-114.
- Chijiiwa K., Nagai M. Bile salt micelle can sustain more cholesterol in the intermicellar aqueous phase than the maximal aqueous solubility. Arch Bichem Biophys 1989; 270(2): 472-477.
- Chijiiwa K., Hirota I., Noshiro H. High vesicular cholesterol and protein in bile are associated with formation of cholesterol but not pigment gallstones. Dig Dis Sci 1993; 38: 161-166.
- Lee S.P., Park H.Z., Madani H., Kaler E.W. Partial characterization of a nonmicellar system of cholesterol solubilization in bile. Amer J Physiol 1987; 252: G374-G384.
- Sewell R.B., Mao S.J.T., Kawamoto T., LaRusso N.F. Apolipoproteins of high, low, and very low density lipoproteins in human bile. J Lipid Res 1983; 24: 391-401.
- Klimov A.N., Nikulcheva N.G., eds. Lipoproteins, dislipoproteinemias, and atherosclerosis. Moscow: Medicine, 1984: 1-168.
- Cooper A.D. Plasma lipoprotein metabolism. In: Fromm H., Leuschner U., eds. Bile Acids-Cholestasis-Gallstones. Advances in Basic and Clinical Bile Acid Research. Dordrecht: Kluwer, 1996: 97-126.
- Miettinen T.A., Kesaniemi Y.A. Cholesterol absorption: regulation of cholesterol synthesis and elimination and within-population variations of serum cholesterol levels. Amer J Clin Nutr 1989; 49: 629-635.
- Del Pozo R., He C., Meyer G., Muller I., Frimberger E., Jungst D. Correlation of cholesterol in vesicles to total protein and the relevance of protein-lipid interaction in gallbladder bile of patients with gallstones. Gastroenterology 1997; 112(4): A502.
- Eckhardt E.R., van de Heijning B.J., van Erpecum K.J., Renooij W., Van Berge Henegouwen G.P. Quantitation of cholesterol-carrying particles in human gallbladder bile. J Lipid Res 1998; 39(3): 594-603.
- Sahlin S; Ahlberg J; Reihnir E; StAhlberg D; Einarsson K. Cholesterol metabolism in human gallbladder mucosa: relationship to cholesterol gallstone disease and effects of chenodeoxycholic acid and ursodeoxycholic acid treatment. Hepatology 1992; 16(2): 320-326.
- Cooper A.D. Metabolic basis of cholesterol gallstone disease. Gastroenterol Clin North Amer 1991; 20: 21-46.
- Glickman R.M., Sabesin S.M. Lipoprotein metabolism. In: Arias I.M., Boyer J.L., Fausto N., Jakoby W.B., Schachter D.A., Shafritz D.A., eds. The Liver, Biology and Pathobiology. 3rd ed. New York: Raven Press, 1994: 391-414.
- Kesaniemi Y.A., Miettinen T.A. Metabolic epidemiology of plasma cholesterol. Ann Clin Res. 1988; 20: 26-31.
- Jonas A., Hesterberg L.K., Drengler S.M. Incorporation of excess cholesterol by high-density serum lipoproteins. Biochim Biophys Acta 1978; 528: 47-57.
- Adams C.W.M., Abdula Y.H. The action of human HDL on cholesterol crystals. Atherosclerosis 1978; 31: 464-471.
- Turumin J.L., Shanturov V.A., Chikotejev S.P., Tarabrin A.L. The low level of Ch-HDL as a risk factor for cholesterol gallstone disease. XIV International Bile Acid Meeting "Bile Acids in Hepatobiliary Diseases - Basic Research and Clinical Application" (Falk Symposium No. 93). Freiburg, Germany, 1996: A106.
- Della Guardia P., Grossi A., Elisei W., Eramo A., de Santis A.D., Attili AF., Genco A., Basso N., Ginanni Corradini S.G. Plasma lipoproteins affect rate of cholesterol absorbed from bile by gallbladder: preliminary data. Ital J Gastroenterol Hepatol 1999; 31(7): 587-592.
- Cavallini A., Messa C., Mangini V., Argese V., Misciagna G., Giorgio I. Serum and bile lipids in young women with radiolucent gallstones. Am J Gastroenterology 1987; 82: 1279-1282.
- Tilvis R.S., Aro J., Strandberg T.E., Lempinen M., Miettinen T.A. In vitro synthesis of triglycerides and cholesterol in human gallbladder mucosa. Scand J Gastroenterology 1982; 17:335-340.
- Carey M.C., Hernell O. Digestion and absorption of fat. Semin Gastrointestinal Dis 1992; 3: 189-208.
|